Bizu (Química e Farmácia) | Espectroscopia: Espécies orgânicas absorventes na região do UV-VIS
Olá pessoal, tudo bem? Me chamo Diego Souza, sou professor novo aqui no Estratégia Concursos da área de Química e Perito Criminal da PCDF. Hoje trago mais uma dica sobre espectroscopia para você que é Químico(a) ou Farmacêutico(a) e está se preparando para algum concurso da área, tais como de Analista de Laboratório, de Especialista das Agências de Regulação, de Perito Criminal, seja da Polícia Civil, Polícia Científica ou Polícia Federal, dentre outros.
Um tema frequentemente cobrado nesses tipos de provas é qual(is) “parte(s)” (grupos) das moléculas orgânicas são responsáveis pela absorção de radiação nas regiões ultravioleta (UV) e visível (VIS). Para acertar, você precisará memorizar algumas faixas de comprimento de onda e suas respectivas transições eletrônicas. Farei uma abordagem qualitativa da energia dos elétrons envolvidos nessas transições para lhe ajudar na memorização. Ao final deste artigo, resolverei alguns exercícios de espectroscopia para a melhor compreensão de como esse assunto pode ser cobrado.
A maioria das ligações em compostos orgânicos é covalente, em que há compartilhamento de elétrons entre os dois átomos envolvidos. Por ora, um entendimento mais superficial das ligações é suficiente para acertar as questões de espectroscopia sobre “Espécies orgânicas absorventes na região do UV-VIS”. Considere que o orbital é uma região em torno do núcleo do átomo onde é mais provável de se encontrar os elétrons. E que a ligação covalente é uma sobreposição de orbitais de dois átomos, resultando no compartilhamento de elétrons.
As ligações covalentes podem ser do tipo sigma (σ) em que a sobreposição dos orbitais é frontal, e do tipo pi (π) em que a sobreposição é lateral. Observe a ilustração desses dois tipos de ligações na figura (a) abaixo.
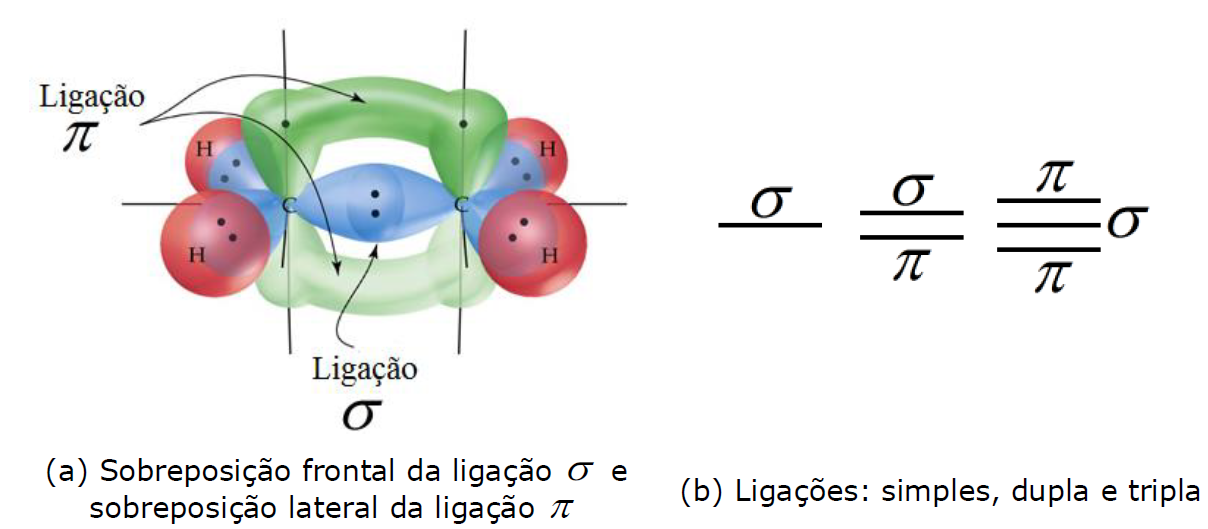
Uma maior sobreposição dos orbitais produz uma maior estabilização da ligação, diminuindo, portanto, a sua energia. Por isso, a ligação σ apresenta menor energia que a ligação π. A aproximação entre dois átomos permite apenas 1 sobreposição frontal de seus orbitais. De tal modo que a ligação simples será σ, e nas ligações duplas e triplas, haverá uma ligação σ e as demais serão π conforme ilustra a figura (b) acima. Em orgânica, a presença de ligações duplas ou triplas entre carbonos é chamada de insaturação. E heteroátomo é qualquer átomo diferente de carbono que esteja entre carbonos, por exemplo: H3C-O-CH3. A cadeia é dita heterogênea quando contém um heteroátomo.
CUIDADO! Caso o átomo esteja ligado a um só carbono, não será heteroátomo, por exemplo: H3C-CH2-OH.
Antes de falarmos dos tipos de transições em compostos orgânicos, apresento dois conceitos importantíssimos para sua prova:
a) Cromóforos: são os grupos orgânicos, geralmente insaturados (ex: C=C, C=O, -NO2), presentes nas moléculas que absorvem a radiação eletromagnética nas regiões UV e VIS.
b) Auxocromo: são grupos que quando ligados ao cromóforo, alteram a intensidade e comprimento de onda de absorção (Ex: -COOH, -OH, -SO3H, -NHR, -NR2, -NH2).
Na espectroscopia, a absorção de luz por espécies químicas promove a excitação de elétrons para níveis mais energéticos, ou seja, orbitais mais externos do átomo. Considerando ainda que os elétrons da ligação σ apresentam menor energia em relação aos elétrons da ligação π, será necessária, portanto, uma maior energia (E) para a excitação de elétrons da ligação σ e, consequentemente, menores comprimentos de onda (λ), já que E e λ são inversamente proporcionais (caso não saiba porque são inversamente proporcionais, verifique na aula AULA 00 do nosso curso, disponível para baixar).
Alguns átomos apresentarão pares de elétrons não ligantes (aqueles que não participam das ligações), representados por n, que possuem energia superior aos elétrons das ligações σ e π. Observe, na figura abaixo, o posicionamento energético de cada orbital e as transições. O tamanho da “seta” indica a quantidade de energia requerida para cada excitação eletrônica.
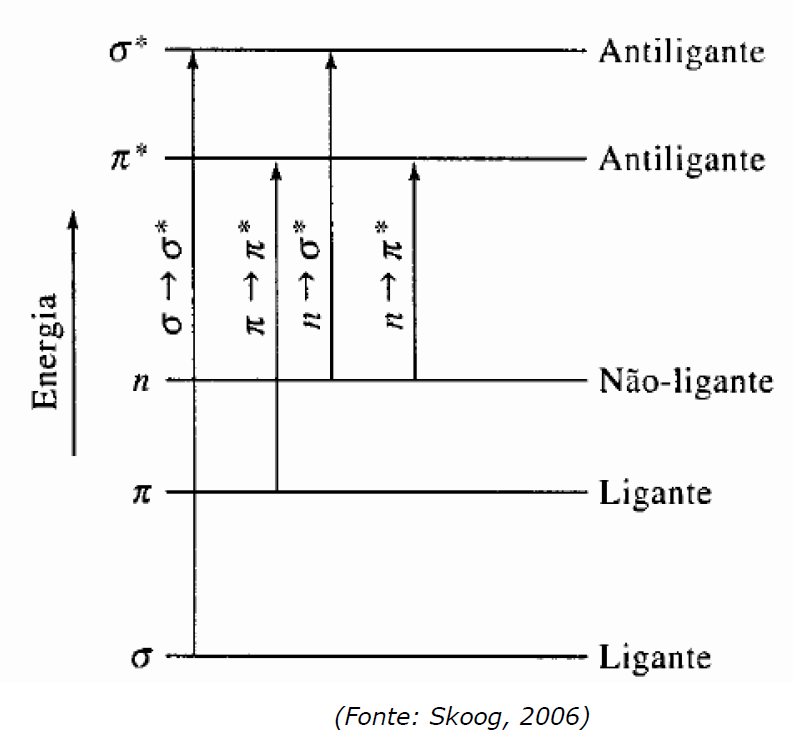
Há um orbital antiligante (π*, σ*) correspondente a cada orbital ligante (π, σ). As excitações eletrônicas em ordem crescente de energia são: n→π*; π→π*; n→σ*; σ→σ*. Memorize que a transição σ→σ* exige λ < 150nm, já que essa transição exige a maior E e, portanto, os menores λ. A partir desse valor, poderá lembrar-se das outras faixas presentes na tabela abaixo, já que quanto menor a E requerida, maior será o λ.
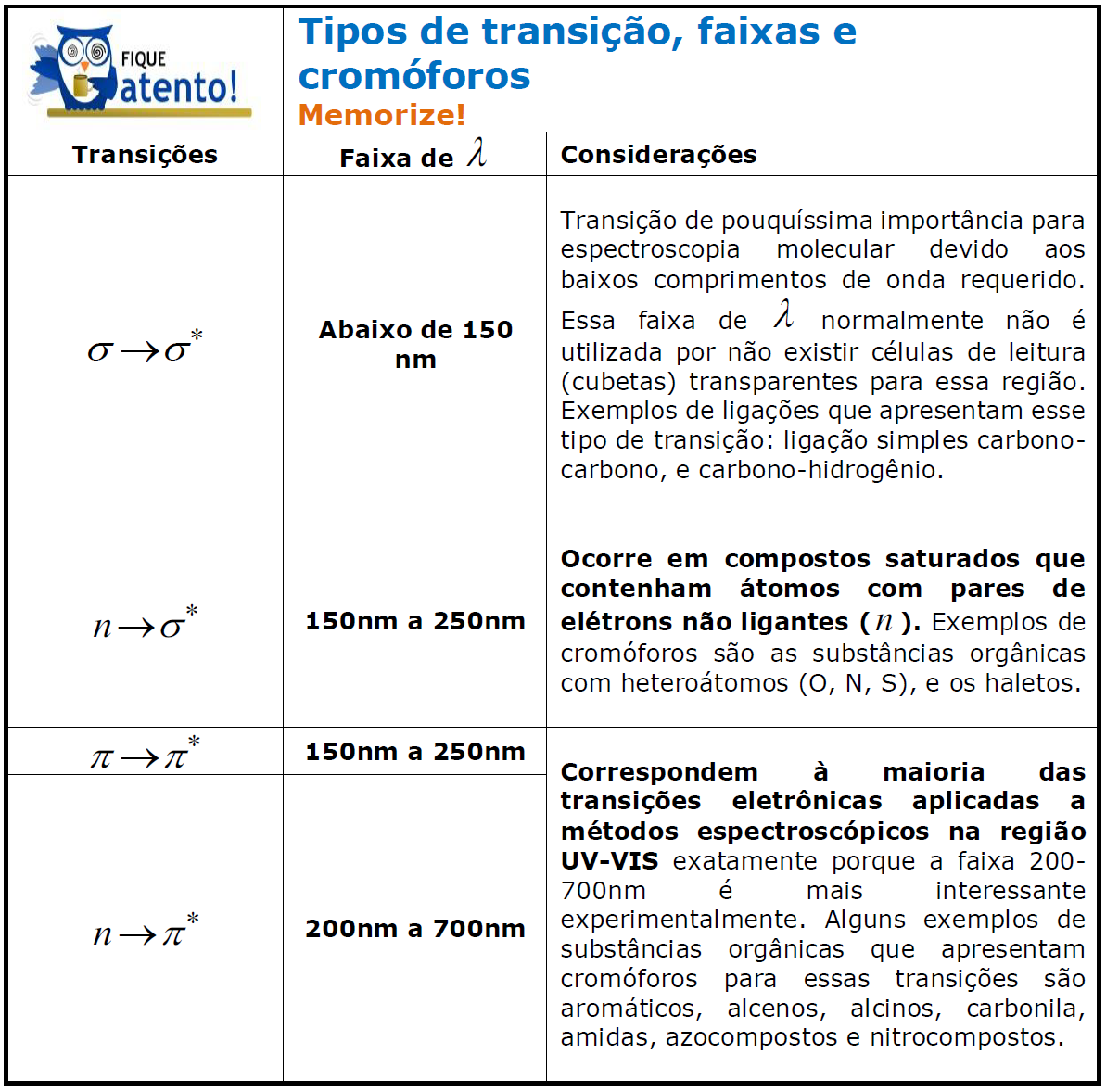
Já que os cromóforos (grupos absorventes) constituem as moléculas, pode-se dizer que a molécula é promovida a um estado excitado ao absorver luz. Ou seja, a transição pode ser atribuída tanto a um fenômeno eletrônico como a um fenômeno molecular. Lembre-se de que uma única molécula pode conter vários cromóforos, o que pode resultar em diferentes bandas de absorção para uma mesma molécula.
Com a memorização das faixas apresentadas na tabela somada ao conhecimento básico em química orgânica sobre estruturas de moléculas, você acertará todas as questões de espectroscopia que abordarem cromóforos e respectivas faixas de transição. Caso tenha dificuldade de memorização, assim como eu (rs), elaborei um Bizu muito útil e que simplifica essa memorização. Confira!
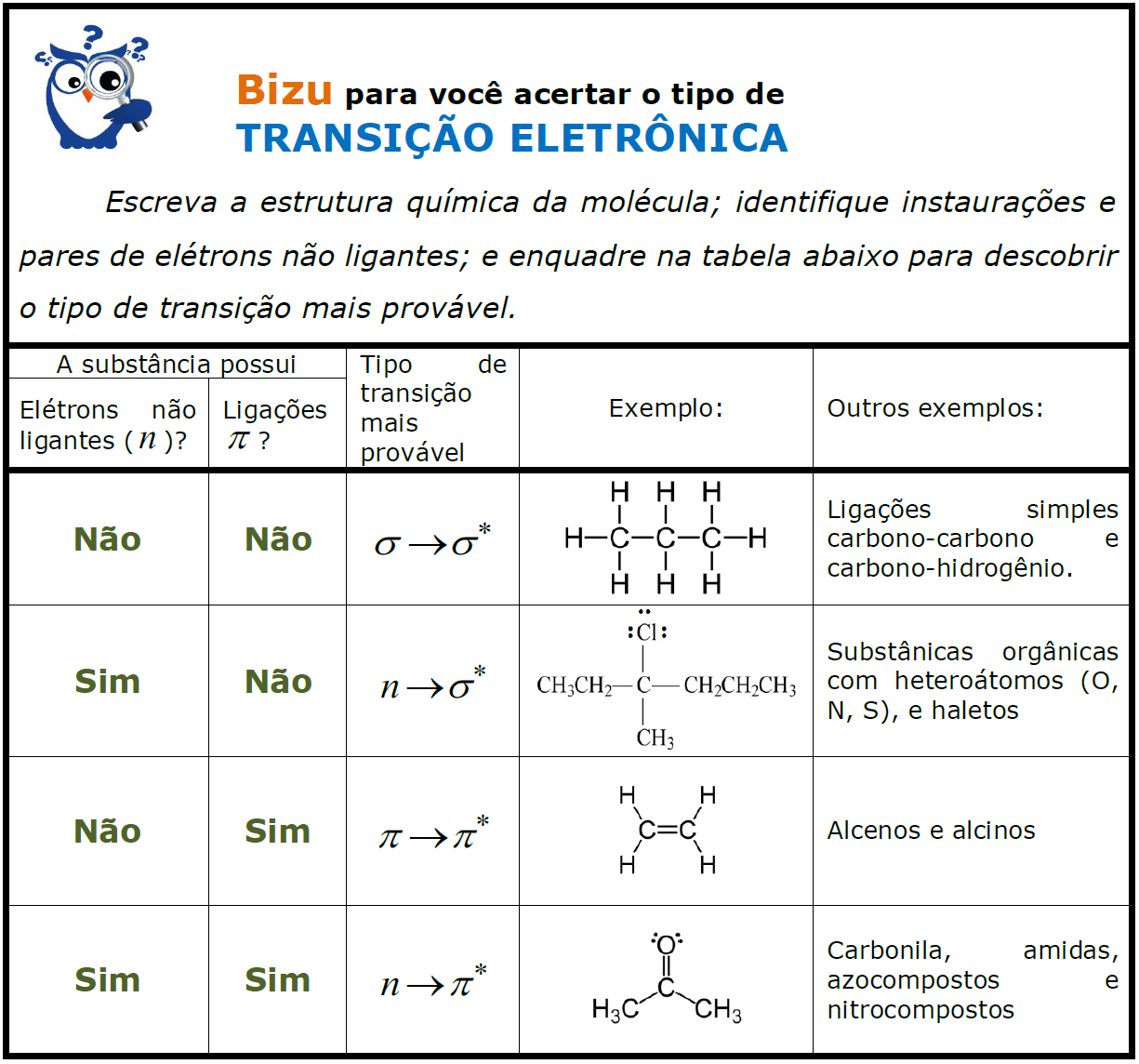
A literatura disponibiliza valores de bandas características para vários cromóforos de diferentes substâncias. Você não precisa memorizá-los. É importante saber que esses dados devem ser utilizados apenas como orientação em estudos de identificação, pois vários fatores podem deslocar a posição e intensidade dessas bandas: estrutura da molécula, tipo de solvente, e conjugação de cromóforos. Além disso, as transições vibracionais e rotacionais alargam as bandas de absorção molecular nas regiões UV e VIS, o que pode provocar sobreposições de bandas.
Leiam mais uma dica sobre espectroscopia no artigo do link abaixo:
Pessoal, vou ficando por aqui. Abaixo, resolvo alguns exercícios sobre assunto aqui debatido. Essas e outras explicações sobre espectroscopia (radiação eletromagnética, interação luz/matéria e Lei de Lambert-Beer) estão disponíveis na AULA 00 do nosso curso, no link abaixo, a qual vocês poderão baixar gratuitamente. Nosso curso traz a base necessária para a maioria dos concursos na área de química, especialmente para os de Perito Criminal, seja da Polícia Civil, Polícia Científica ou Polícia Federal.
CURSO REGULAR PARA PERITO CRIMINAL (Química) | Endereço para baixar a AULA 00
Exercícios comentados
(IBFC – Perito Criminal/Química – PCRJ – 2013) A espectroscopia molecular baseada na radiação ultravioleta, visível e infravermelha é amplamente empregada para a identificação e determinação de muitas espécies inorgânicas, orgânicas e bioquímicas.
Indique a alternativa que apresenta a correta definição para cromóforo.
- Cromóforos são solventes utilizados nas análises espectroscópicas moleculares para identificar analitos em uma amostra.
- Cromóforos são detectores acoplados nas análises espectroscópicas moleculares para absorção de radiação na região do infravermelho.
- Cromóforos são grupos funcionais orgânicos e inorgânicos insaturados que absorvem na região do infravermelho, ultravioleta ou visível.
- Cromóforos são grupos funcionais orgânicos insaturados que absorvem na região do ultravioleta ou visível
- Cromóforos são grupos funcionais orgânicos saturados que absorvem na região do visível.
Resolução: estudamos que cromóforos são os grupos orgânicos, geralmente insaturados (ex: C=C, C=O, -NO2), presentes nas moléculas que absorvem a radiação eletromagnética nas regiões UV e VIS.
Gabarito: letra D
(UFG – Analista Técnico Químico – CELG – 2014) Dois importantes cromóforos que apresentam bandas de absorção nos espectros visível e ultravioleta são as ligações C=O e C=C, cujas transições características são, respectivamente,
- π→π* e n→π*
- π*→π e π*→n
- n→π* e π→π*
- n→π* e n→π*
- π→π* e π→π*
Resolução: a carbonila C=O apresenta elétrons não ligantes (n) no átomo de oxigênio, pois ele possui 6 elétrons na última camada e está realizando apenas duas ligações covalentes, restando 2 pares de elétrons não ligantes. Desta forma, a transição associada a esse grupo será n→π*. Já o cromóforo C=C não apresenta elétrons não ligantes, pois o carbono possui 4 elétrons na última camada e faz 4 ligações. A transição é, portanto, do tipo π→π*.
Gabarito: letra C
(CESPE – Perito Criminal de CE – 2012) Na espectroscopia na região do ultravioleta, os sinais de absorção são gerados a partir de transições eletrônicas, sendo as transições mais comuns as que envolvem elétrons de orbitais moleculares π→π* e n→π*.
Resolução: essas duas transições correspondem à maioria das transições eletrônicas aplicadas a métodos espectroscópicos na região UV-VIS exatamente porque apresentam bandas de absorção entre 200 e 700nm, que é a faixa mais interessante experimentalmente. (Dica: memorize nossa tabela esquemática sobre as transições)
Gabarito: certo
(CESGRANRIO – Técnico Químico de Petróleo Júnior – Petrobras – 2012) A absorção de luz por uma molécula ocorre em regiões específicas que são denominados grupos:
- cromóforos
- isóbaros
- auxocrômicos
- anfóteros
- isoméricos ópticos
Resolução: Cromóforos são os grupos orgânicos, geralmente insaturados (ex: C=C, C=O, -NO2), presentes nas moléculas que absorvem a radiação eletromagnética nas regiões UV e VIS.
Gabarito: letra A