Concurso PF: confira o gabarito extraoficial de Química com comentários
Olá, guerreiros! Como se saíram na prova da Polícia Federal?
Aqui é o Diego Souza, Perito Criminal e Prof. de Química. Neste artigo disponibilizo o gabarito extraoficial da prova e também teço rápidos comentários sobre as questões de Química da prova de Papiloscopista da PF que aconteceu neste domingo, 23. Vamos lá?!

Gabarito extraoficial comentado – Química – Papiloscopista | Polícia Federal
Texto apresentado:
Existem diversas técnicas para a coleta de impressões digitais em cenas de crimes que estão relacionadas com a composição do suor. O suor, simplificadamente, é uma solução aquosa de eletrólitos. O Na+ é um dos eletrólitos encontrados no suor pela dissolução de sais, por exemplo, o cloreto de sódio, cuja entalpia de dissolução em água é igual a -3,8 Kj/mol. O sódio é do grupo 1, ou família 1ª, e está no terceiro período da Tabela Periódica. Acerca desse assunto, julgue os itens a seguir.
113. O eletrólito de sódio citado no texto fica no mesmo grupo do átomo neutro, mas se posiciona no segundo período da Tabela Periódica.
Resposta: ERRADO
Comentários: A afirmação está incorreta. Primeiramente, a Tabela Periódica apresenta átomos na forma neutra e não na forma iônica. Conforme o texto, o sódio (Na) se localiza no primeiro grupo ou família 1A e está no terceiro período da Tabela Periódica.
114. O suor tem temperatura de ebulição maior que a da água pura.
Resposta: CERTO
Comentários: Assertiva sobre propriedades coligativas. Por conter eletrólitos não voláteis, como o sódio (NaCl), o suor apresenta ponto de ebulição superior ao da água pura.
115. A temperatura da água aumenta com a dissolução de NaCl.
Resposta: CERTO
Comentários: A dissolução de cloreto sódio (NaCl) em água consiste em uma dissolução exotérmica, isto é, ao dissolver NaCl em água ocorre liberação de energia na forma de calor o que acarreta no aumento da temperatura da água. Essa informação, pode ser obtida no texto, pois fornece a entalpia de dissolução do NaCl em água, cujo valor é menor que zero (negativo), característica de processos exotérmicos em que a energia dos produtos é maior que a dos reagentes.
Texto apresentado:
Uma das técnicas mais utilizadas para a coleta de impressões digitais faz uso de pós. A interação de pós com os componentes da impressão digital se dá, normalmente, por interação de Van der Waals. É comum utilizar óxido de ferro (III) – Fe2O3– na formulação desses pós. A revelação da impressão feita com Fe2O3 pode ser destruída pela presença de ácidos, por causa da seguinte reação:
Fe2O3 (s) + xH+ (aq) <> yFe3+(aq) + z H2O (l)
Com base nessas informações, julgue os seguintes itens.
116. A constante de equilíbrio K da reação do óxido de ferro (III) é corretamente expressa pela seguinte equação.
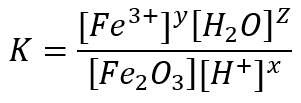
Resposta: ERRADO
Comentários: Item errado, uma vez que sólido e água líquida não participam da equação da constante de equilíbrio. O F2O3 (s) foi posto no denominador e a H2O no numerador.
117. O óxido de ferro(III) é um peróxido.
Resposta: ERRADO
Comentários: Em compostos iônicos binários podemos subir os subíndices de forma cruzada para obter a carga dos átomos. Fazendo isso, notamos que o Ferro possui carga +3 e o Oxigênio -2. Já em peróxidos, ex: Na2O2, o NOX do oxigênio é -1. Portanto, o referido óxido não é um peróxido.
118. Na reação do F2O3 apresentada, o ácido é o catalizador.
Resposta: ERRADO
Comentários: O catalisador participa da reação sem ser consumido, isto é, sempre é regenerado ao final da reação. Assim, como o ácido, apresentando na reação como H+, não foi regenerado, ele não é um catalisador.
119. A estequiometria correta da equação química apresentada é obtida com os seguintes valores x, y e z, respectivamente: 6, 2 e 3.
Resposta: CERTO
Comentários: Com a aplicação direta do método das tentativas, a estequiometria correta para a reação seria 6,2 e 3, consoante a afirmativa. Note que não só os compostos ficam balanceadas, mas também as cargas. Este último detalhe é importante para certificar que os coeficientes estão corretos.
120. A interação intermolecular citada no texto envolve atração entre cargas de sinais opostos.
Resposta: ERRADO*
Comentários: Como a própria questão informa, forças de Van der Waals é um tipo de interação intermolecular (entre moléculas). Como moléculas, do ponto de vista da Química, são espécies eletronicamente neutras por apresentarem equivalência entre o número de cargas positivas dos prótons e o número de cargas negativas dos elétrons que os orbitam. Nesse sentido, o item estaria ERRADO ao mencionar que essa interação se dá entre cargas opostas, remetendo ao conceito de íons, espécies carregadas positivamente (cátions) ou negativamente (ânions). No entanto, a questão abre espaço para dupla interpretação visto que moléculas polares apresentam polos positivos e polos negativos, considerados na química como cargas parciais. E mesmo as moléculas apolares, sob a indução de uma carga ou polo externos, podem sofrer distorção de suas nuvens eletrônicas, resultando na formação de polos mais fracos e temporários. Como alguns autores consideram esses polos como cargas, o item poderia ser considerado CORRETO. A conferir se banca irá se apegar mais ao fato de as moléculas serem espécies eletronicamente neutras ou ao entendimento de alguns autores de considerarem polos na molécula, mesmo os temporários, como cargas. Apostamos que banca considerará o item ERRADO, mas, em ambas possibilidades, haverá literatura útil para elaboração de recurso contra o gabarito da banca, mas também para a banca se ancorar e manter seu gabarito.
Abraços!