Questões resolvidas – Concurso p/ Engenheiro da Aeronáutica (EAOEAR 2018)
Questões comentadas da prova de Engenharia Química
Olá, concurseiros da engenharia! Tudo tranquilo?
Neste último domingo (28/05) tivemos as provas para o Estágio de Adaptação de Oficiais Engenheiros da Aeronáutica do ano de 2018 (EAOEAR 2018). Promovido pelo Centro de Instrução e Adaptação da Aeronáutica (CIAAR). Trata-se de um concurso que ocorre ANUALMENTE e apresenta vagas para diversas engenharias. Além disso, as provas objetivas e escritas podem ser realizadas em diversas capitais do Brasil.
Como sou professor dos cursos de Engenharia Química, trouxe hoje umas questões comentadas dessa prova de assuntos bem pertinentes da nossa área: balanço de massa e termodinâmica. Esses assuntos estão sempre presentes em provas de concursos militares, agências reguladoras, Petrobras, institutos de perícia e etc. Vamos conferir:
Q38. (CIAAR 2017 – Engenharia Química/Aeronáutica)
O balanço de massa representa uma peça fundamental do projeto de equipamentos e torna-se complexo quando tratamos de processos constituídos por diversos equipamentos interligados. Tal complexidade aumenta em sistemas multifásicos, heterogêneos e com reações químicas.
Analise as assertivas abaixo.
I. Um sistema pode ser denominado fechado quando não existe fluxo de massa através de suas fronteiras; e aberto quando a massa flui através das fronteiras do mesmo.
II. A partir do balanço de massa, podem ser obtidas tantas equações, quantos forem os componentes do processo.
III. O tempo investido na coleta e compreensão de informações do problema previne o tempo gasto com correção ou reinício do mesmo.
IV. Na operação em regime estacionário, os valores das variáveis de processo variam com o tempo em alguma posição fixa do processo.
Está correto apenas o que se afirma em
a) I e III. b) I, II e III. c) I, II e IV. d) II, III e IV.
Resolução:
(I) CORRETA: Sistemas fechados são aqueles em que a matéria não pode fluir pelas fronteiras, mas é possível o fluxo de energia. Em sistemas abertos, tanto massa como energia podem transitar livremente pela fronteira do sistema. Portanto, a afirmativa classifica corretamente os sistemas quanto ao fluxo de massa.
(II) CORRETA: Você pode efetuar um balanço de massa para cada componente e obter um número de equações igual a quantidade de componentes presentes.
Por exemplo: balanço do componente 1 + balanço do componente 2 + … + balanço do componente N
Veja que o número de equações será igual a N.
Vale salientar que a equação do balanço total (englobando todos os componentes) não é contabilizada, pois ela é simplesmente obtida pela adição dos balanços de cada componente. Ou seja, não é uma equação independente.
(III) CORRETA: A afirmativa busca avaliar o bom senso de engenheiro. Estudar o processo e suas variáveis torna a operação mais previsível e economiza tempo com correções.
(IV) INCORRETA: Exatamente o oposto. Na operação em regime NÃO-estacionário (ou transiente), os valores das variáveis de processo variam com o tempo em alguma posição fixa do processo.
GABARITO: B
Q45. (CIAAR 2017 – Engenharia Química/Aeronáutica)
Uma amostra de gás ideal sofreu uma transformação termodinâmica à pressão constante igual a 30 N/m2. O volume e a temperatura absoluta variam como indica o gráfico a seguir.
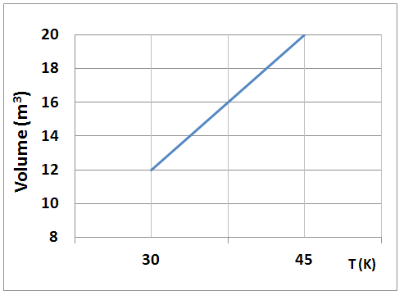
Sabendo-se que, nessa transformação, o gás absorve 400J de calor, pode-se afirmar que a variação de sua energia interna é de
a) 50J. b) 100J. c) 140J. d) 160J.
Resolução:
A questão nos pede para avaliar a variação de energia interna (ΔU), fornecendo como dados o calor absorvido (Q) e a variação de volume (V) e temperatura (T) do sistema. Assim, podemos usar a Primeira Lei da Termodinâmica:
ΔU = Q + W
Trata-se de um balanço de energia para um sistema fechado, composto pelo gás ideal em questão. O calor é absorvido pelo sistema, logo o sistema “ganha” essa energia, por isso aplica-se o sinal positivo:
Q = + 400 J
Já o trabalho pode ser calculado com base na variação de volume fornecida pelo gráfico. Como o trabalho é de expansão, o sistema “perde” energia com ele. Assim esperamos um sinal negativo, como iremos constatar ao aplicar a fórmula para o trabalho:
W = -P. ΔV
W = – (30 N/m2) . (20 m3 – 12 m3)
W = – (30 N/m2) . (8 m3)
W = – 240 J
Ou seja, o sistema absorve 400 Joules sob a forma de calor, mas rejeita 240 Joules como trabalho. Agora basta aplicar a equação de primeira lei para encontrarmos a variação da energia interna:
ΔU = + 400 J – 240 J
ΔU = + 160 J
GABARITO: D
Se você é da área de Engenharia, pode conferir AQUI um resumo feito por mim dos concursos para engenheiros.
Confira também o curso regular "Engenharia Química para concursos", que trata destas matérias e de outras essenciais para concursos públicos para essa formação:
CURSO REGULAR – ENGENHARIA QUÍMICA
Abraço!
Prof. Victor Augusto